現階段腐蝕實驗是探究金屬腐蝕以及防護的主要手段,通過腐蝕實驗可以探究金屬發生腐蝕的規律及機理、檢查并篩選金屬材料的材質、估算金屬材料的使用壽命、分析金屬材料腐蝕事故的原因以及驗證防腐蝕的效果等。目前探究金屬腐蝕以及防護的方式有多種,如表面分析法、失重法以及電化學法。因為大部分金屬產生的腐蝕都是電化學腐蝕,而腐蝕過程中發生的電化學反應為電化學腐蝕的本質,所以金屬/電解質界面(雙電層)的電化學性質被大量使用于探究金屬腐蝕發生的規律、腐蝕產生的機理等方面。因此,在現有的研究金屬腐蝕與防護的方法中,電化學方法是一種較為重要的方法。腐蝕電化學法能夠按照腐蝕金屬電極特點的不同而分為以下三種類型:①. 電化學動力研究方法,指利用控制極化電流及電極電位來測定腐蝕體系中的熱力學參數;②. 獨用的腐蝕電化學測量跟研究法,指按照金屬電化學腐蝕的獨特性建立相應的電化學測量跟研究方法;③. 通過模擬裝置來探究具有獨特腐蝕形態的電化學測試技術,如模擬SSRT裂紋尖端的裝置、研究縫隙腐蝕的閉塞電池等。這幾種方法中最基礎的為電化學動力法。
電極電位以及電流密度為腐蝕電化學實驗所要獲得的重要參數,其中電極電位表示電解液-金屬界面的特性和結構;電流密度表示金屬材料表面上單位面積內電化學反應進行的快慢。絕大多數電化學測試都是測定電極電位跟電流密度這兩者間的關聯。
與其他電化學過程(如電鍍、電解及化學電源等)相比,金屬電化學腐蝕測量過程的對象是金屬電極,該過程有如下特點:
1. 金屬發生腐蝕的整個腐蝕體系由數個電極反應耦合而成,同時在整個電極表面上也發生著數個電極反應,所以與只具有一個電極反應的電極系統相比,其在分析和處理腐蝕電化學實驗結果上有著一定特別之處。
2. 電極金屬材料發生陽極溶解反應,即腐蝕金屬自身參與的反應是電極系統中電極反應中的一種。
3. 測量過程中不可以只探究整個電極表面總的電化學行為,因為電極表面表現為多層結構,金屬電極上有著腐蝕產物銹層、腐蝕孔及表面膜,導致電極表面具有不光滑的特點,容易發生各種形式的局部腐蝕,所以有必要發展如微區電化學測試之類的能夠表征電極表面不均勻性的研究方法。
4. 腐蝕金屬的電極反應相對于其他一些電化學過程而言比較緩慢。
此外,腐蝕電化學測試方法為原位技術,能夠比較真實地反應金屬電極表面發生的實際腐蝕,擁有較強的靈敏度、操作簡單容易實施且實時性好的優點。電化學實驗常用的方法有極化曲線、交流阻抗及電位掃描等。
極化曲線的測量有利于研究電極過程的影響因素和機理。眾所周知,當我們探究可逆電池的反應時電極上基本上是不存在電流的,各個電極的反應基本都在平衡狀態下發生,所以該反應為可逆的。但是一旦存在電流通過,電極原本的平衡狀態就被打破,進而導致電極電位偏離原本的平衡電位值,導致電極反應處于一種不可逆的狀態,不可逆程度隨著電極電流密度的升高而增強,即所謂的電極極化就是指由于電流通過電極而導致電位偏離平衡值的一種現狀,極化曲線即表示電極電位與電流密度兩者間的關系,其測試有以下幾種方法。
a. 恒電位法
恒電位法即將被研究的電極電位固定在不同的電位上,然后測試對應電位下的電極電流密度,在實際應用過程中使用較為普遍的是靜態法及動態法。所謂靜態法是指控制電極電位為某一個特定值,測量相對應電位下的電流密度,且依次測定整個電極電位下的電流密度,從而得到整個極化曲線;其次動態法指控制電極電位按照較為緩慢的速度不停地變化,并且測量相對應電位下的電流值,瞬時電流與其相對應的電位關系曲線即為極化曲線。這兩種方法中較為廣泛使用的是動態法測定極化曲線,該方法的優點在于掃描速度可以控制、可以自動測量并繪制極化曲線,其測量的結果有較高的重現性,對于那些需要比較的實驗該方法為首選。
b. 恒電流法
恒電流法是指固定電極體系的電流密度為某一特定值,測定跟電流密度相對應的電極電位。恒電流法測量極化曲線在測定過程中電極很難達到一個穩定的狀態,所以在實際測量過程中一般當電位接近穩定的時候即可以讀值。
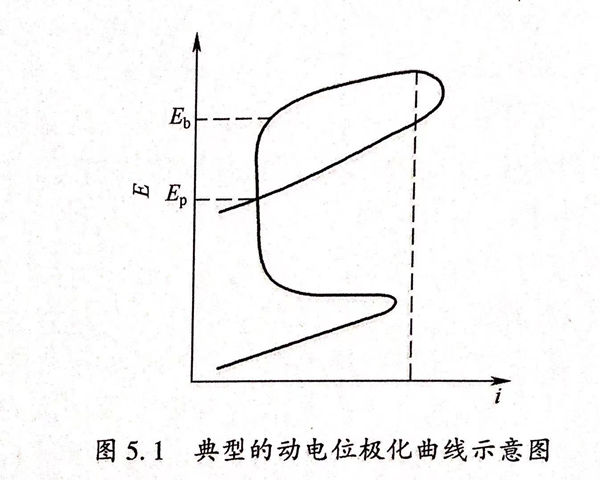
典型的動電位極化曲線如圖5.1所示。圖中Eb為金屬材料的點蝕電位,Ep為保護電位。同樣的實驗狀態下點蝕電位(Eb)值越大則意味著金屬產生點腐蝕的傾向越低;當幾種金屬材料的點蝕電位值相當,只有將點蝕電位和保護電位綜合考慮才能評價金屬的耐蝕能力,(Eb-Ep)差值越低表明材料鈍化膜修復能力越強,耐孔蝕性能越優,因而保護電位(Ep)和點蝕電位(Eb)是被用來表示金屬耐孔腐蝕能力大小的基本參數。在E>Eb的條件下,點蝕必然會發生,不但原來具有的蝕孔會長大而且還會產生新的蝕孔;在E<Ep的情況下不會發生點蝕,原來的孔蝕不會長大而且新的蝕孔也不會產生;在Ep<E<Eb條件下,孔蝕存在,原有的蝕孔會接著擴展并生長,但是新蝕孔不會產生。
電化學阻抗譜(Electrochemical Impedance Spectroscopy,EIS),在早期的電化學文獻中電化學阻抗又被稱為交流阻抗(Alternating Current impedance,AC im-pedance).電化學阻抗原先被用于電學中來探究線性電路網絡頻率響應特征,后來被用在電極上,進而成為電化學的研究方式。電化學阻抗譜的原理是指向電化學體系施予一頻率各異的小振幅交流電動勢,測定正弦波頻率(ω)的改變對該電動勢與電流信號比值產生的影響,即測定阻抗隨著正弦波頻率(ω)的變化,也可以通過測定阻抗的相位角Φ隨ω的變化來分析電極材料、腐蝕機理、導電材料、電極過程的動力學等方面的機理。采用小振幅的電信號既能夠防止給系統帶來較大的影響,同時又能夠讓擾動跟響應體系之間表現為近似線性的關系,進而讓測量的結果數學處理更容易。此外,電化學阻抗譜是通過測量過程中獲得的頻率比較寬的阻抗譜探究電極的,所以相對于另外一些電化學法其能夠得到電極界面結構和動力學信息。例如:通過阻抗譜形狀能夠探究金屬電極發生腐蝕的機理;探究金屬表面上保護膜的阻抗特征;對腐蝕金屬進行電化學阻抗測量可以獲得極化電阻(Rp);對腐蝕的金屬材料進行電化學阻抗譜測量,能夠了解動力學參數進而來研究金屬材料抗腐蝕能力的強弱等。因此,電化學阻抗譜成為近年來探究金屬發生腐蝕與采取相應防護措施的重要方式。
電化學阻抗(EIS)測試把電化學系統作為一個等效電路,交流阻抗實驗的基本等效電路如圖5.2所示。該電路的組成元件有電阻(R:金屬材料對電流的阻攔功能)、電感(L:于電路中對交流電的阻礙功能)及電容(C:電路中對交流電所引起的阻礙作用)等,這些元件按照串聯或者并聯的方式組合起來形成一個等效電路。測量電化學阻抗能夠確定等效電路的組成方式及各組成元件的值、通過這些元件的電化學含義就可以分析電化學電極過程的性質和電化學系統的結構。




